当医生宣布孩子需要接受放疗时,许多家长都会有一连串问题:“要照多少次?”“用多大剂量?”“总共需要多长时间?”这些数字反映的是家长心中的渴望:得到一个“标准答案”,可以据此安排日常生活和衡量治疗进度。但在儿童肉瘤放疗的复杂世界里,这种“通用方案”并不存在,真正的治疗方案更像是一道道需要医疗团队为每个孩子单独求解的精密“方程式”。
病情“方程式”:理解差异,是治疗的起点
儿童肉瘤放疗的个性化需求,根植于几个无法被简化的变量之中。首先,是肿瘤自身的“个性”。同为儿童常见实体瘤,室管膜瘤倾向于在局部“深耕”,而髓母细胞瘤则擅长沿脑脊液“流窜”。即使是同一种肿瘤,视其生长位置的不同,治疗方案也有差异。
其次,是儿童身体的特殊性。孩子不是缩小版的成人,他们的器官处于旺盛的发育阶段,对辐射异常敏感。大脑的海马体、颅底的垂体、脊柱的生长板以及心、肺、肝、肾等脏器,都是需要重点呵护的“生命线”。放疗计划的制定,必须在攻击肿瘤和保护未来之间做出极其精细的权衡。另外,一个10岁孩子和一个3岁孩子的治疗耐受性和远期风险谱也不一样。
最后,是治疗目标的层级性。是根治性治疗,还是术后辅助巩固?是针对原发灶,还是包含转移灶?是首次治疗,还是复发后的挽救性治疗?目标不同,“解题”的策略和可接受的“代价”就不同。这些因素共同构成了独一无二的“病情方程式”,等待着量身定制的“解”。
对比“解题思路”:当不同肿瘤遇见放疗
要理解方案的个性化,最直观的方式是看两个典型“例题”的解题过程。
例题A:室管膜瘤放疗
室管膜瘤常位于脑室系统,术后残留或复发的病灶如同藏在精密仪器间的“顽固污渍”。这里的“解题”核心是:如何在毫米级的空间里,实施足以杀灭肿瘤的高剂量照射,同时确保紧邻的脑干、视神经、垂体等结构毫发无损?
解题策略: 通常采用高剂量的局部照射,技术关键在于“精准”二字。
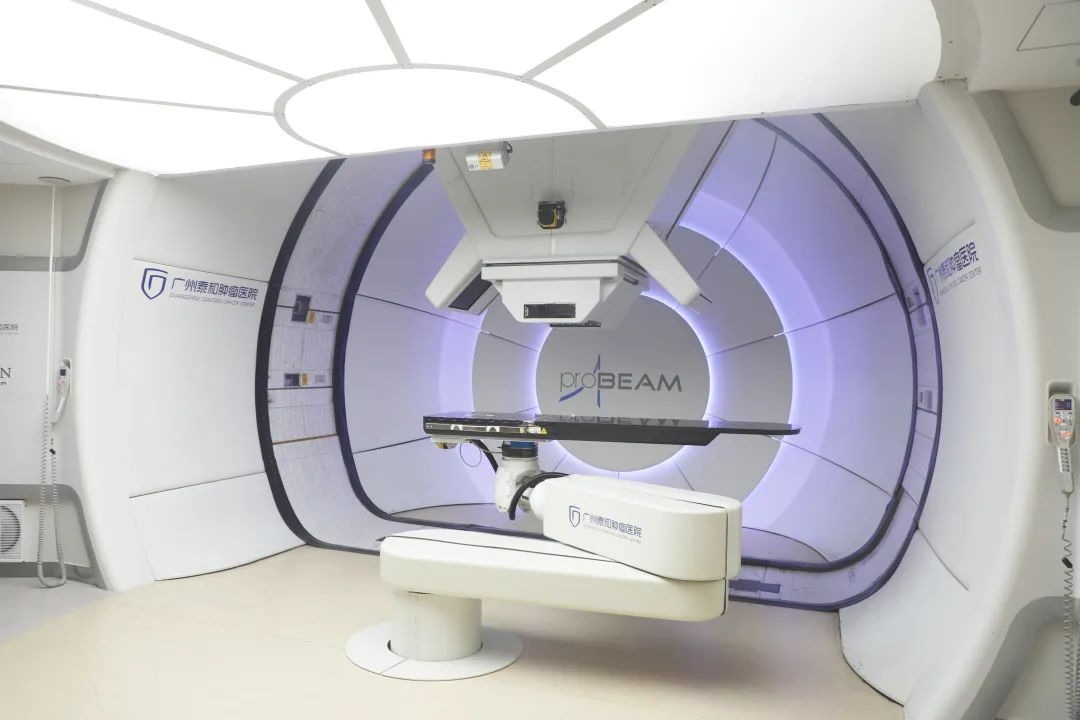
工具选择: 质子治疗因其“布拉格峰”特性成为理想工具。医疗团队可以设计治疗计划,让高剂量区完美包裹瘤床,而剂量在到达脑干等关键结构前便急剧跌落至安全范围。
求解过程:“放疗多少次”和“总剂量”的设定,关键是在肿瘤细胞杀伤效应和正常脑组织修复能力之间找到的最佳平衡点,通常需要30次左右,历时约6周。
例题B:髓母细胞瘤放疗
髓母细胞瘤生长于小脑,极易沿脑脊液播散至整个大脑和脊髓表面,因此其“解题”复杂度陡增。
解题策略:通常采用“全脑全脊髓照射”联合“后颅窝推量”,这是儿童放疗中最复杂、最具挑战性的方案之一。
核心挑战:传统放疗技术(X射线)在照射脊髓时,射线会穿透身体,前方的正常组织和器官会受到影响,为未来数十年的健康埋下隐患。
个性化突破:质子治疗在此展现出革命性优势。通过特殊角度的照射野设计和笔形束扫描技术,质子束可以将能量几乎全部沉积在脊髓靶区内,前方的重要器官则几乎不受影响。
“解”的生成:多学科团队的联合演算
一项个性化放疗方案的诞生,并非由放疗科医生独力完成,而是要经由严谨的多学科联合演算。
首先,由小儿肿瘤外科、病理科、影像科医生提供关键信息,如肿瘤的精确范围、侵袭特性、手术切除情况等,从而定义问题的“边界”。
其次是设定“解题目标”。 放疗科医生会综合所有信息,明确治疗目标(根治/辅助/姑息),并初步确定需要照射的靶区范围和需要保护的危及器官列表及其剂量限值。这是解题的“方向”。
然后是“精密求解”,这是最核心的步骤。物理师运用专业的计划系统,如同使用最先进的CAD软件进行工程设计。他们尝试不同的射线入射角度(质子束路径)、调整能量与强度,进行无数次迭代计算,只为求得一个最优解:即肿瘤靶区剂量足够高且均匀,而所有正常器官的受量均低于安全阈值。他们最终给出的,就是具体的放疗剂量分布图、照射次数和每次照射的剂量分割方案。
接下来是验证。治疗计划必须在模拟条件下进行严格的剂量学验证,确保其精确性。在治疗过程中,还可能根据孩子的体重变化或肿瘤缩小,对计划进行动态调整和再优化。此外,治疗的最佳时期也在这个演算过程中确定——可能是术后伤口愈合后立即开始的辅助放疗,也可能是化疗几个周期后、肿瘤缩小到最佳窗口时的根治性放疗。时机选择,旨在让放疗与手术、化疗产生“协同效应”,而非相互掣肘。
儿童肉瘤放疗,是一场需要极大耐心与精密的生命工程。当家长不再执着于一个简单的“标准答案”,转而开始理解并寻求那个具备高超“个性化解题能力”的医疗团队时,就已经为孩子抓住了在现代医学条件下,赢得最佳疗效与最好生活质量的核心关键。这条路或许复杂,但每一步的深思熟虑,都是通向治愈与未来的坚实基石。










![[快讯]首创证券:关于股东集中竞价减持股份计划_今日观点](http://imgnews.ruanwen.com.cn/2022/0610/20220610111050641.jpg)